文献解读|一种基于钒的纳米平台通过协同类铁死亡治疗和葡萄糖代谢干预增强癌细胞死亡和抗肿瘤免疫
2023-06-12 | Affinity
2023年6月山东大学药学院翟光喜/杨小叶团队在《ASC Nano》上发表“A Vanadium-Based Nanoplatform Synergizing Ferroptotic-like Therapy with Glucose Metabolism Intervention for Enhanced Cancer Cell Death and Antitumor Immunity”的文章,介绍了一种基于钒的纳米平台通过协同类铁死亡治疗和葡萄糖代谢干预增强癌细胞死亡和抗肿瘤免疫。
铁死亡是一种新发现的细胞死亡方式,它是由脂质过氧化引起的。激活类铁死亡被认为是一种强有力的抗癌武器,但是肿瘤细胞存在一些类铁死亡抵抗机制,特别是异常的代谢,这一点往往被低估。
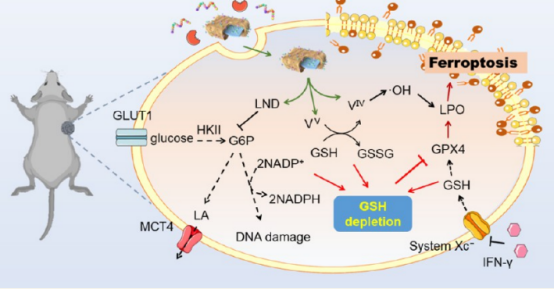
作者提出了一种通过调节肿瘤细胞的糖代谢来增强类铁死亡的模式,并构建了一种名为PMVL的纳米平台,它由载有LND的单宁酸配位氧化钒组成,并伪装了PD-L1抑制肽修饰的肿瘤细胞膜。
该工作揭示了PMVL中钒的混合价态(V IV 和 V V)触发了类铁死亡,这个过程中产生了•OH用于脂质过氧化物积累(V IV → V V)和消耗了谷胱甘肽(GSH)用于谷胱甘肽过氧化物酶(GPX4)失活(V V → V IV)。
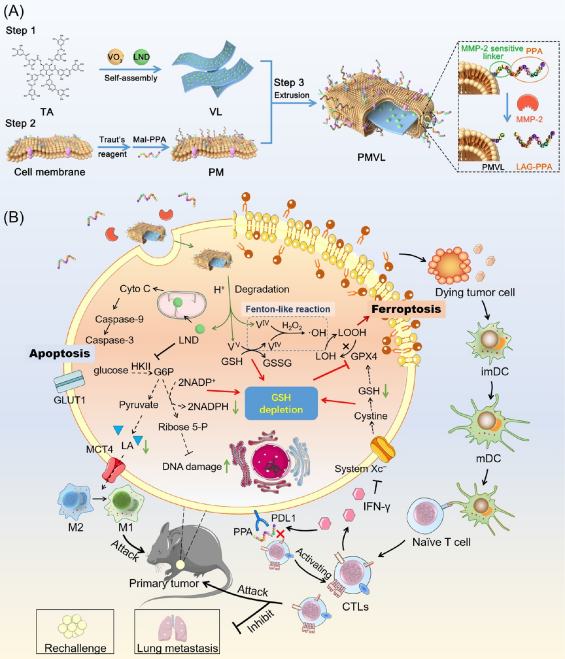
值得注意的是,LND通过双重抑制糖酵解(降低ATP供应)和戊糖磷酸途径(降低NADPH产生),增强了类铁死亡,导致GSH消耗增加。此外,抑制的糖酵解产生较少的细胞内乳酸,并缓解了肿瘤微环境的酸度,防止了免疫抑制性M2巨噬细胞极化。
随后通过研究PMVL诱导的免疫原性细胞死亡,发现PMVL能够增加肿瘤细胞表面的CRT蛋白暴露,从而激活树突状细胞和T细胞,抑制PD-L1和HIF-α的表达。
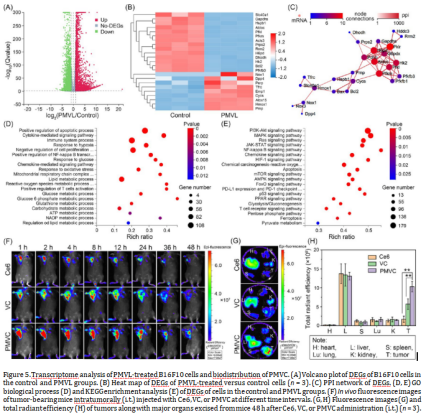
而通过研究PMVL对小鼠B16F10黑色素瘤模型的治疗效果,发现PMVL能够显著抑制肿瘤生长和转移,延长小鼠寿命,增强免疫记忆效应。
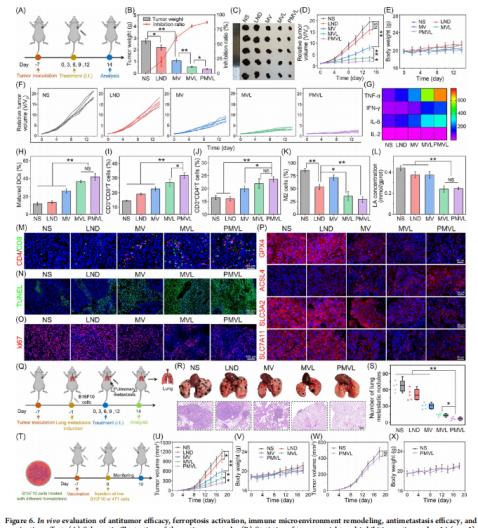
体外和体内数据证明了糖代谢干预增强的类铁死亡和免疫激活,为协同癌症治疗提供了机会和可能性。
该研究用到了Affinity品牌的CRT抗体(Cat#DF6211),CRT蛋白是指钙网蛋白(calreticulin),它是一种内质网蛋白,参与钙离子的调节和蛋白质的折叠。在类铁死亡中,CRT蛋白被认为是一种免疫原性细胞死亡的标志物,能够在细胞表面暴露,从而激活抗肿瘤免疫。
Affinity也提供铁死亡通路其它相关蛋白抗体可供选择:
GPX4:一种类铁死亡关键酶,能够消除脂质过氧化物,保护细胞膜的完整性。(GPX4 Antibody - #DF6701)
ACSL4:一种脂肪酸合成酶,能够催化多不饱和脂肪酸(PUFA)的活化,促进脂质过氧化物的产生。(ACSL4/FACL4 Antibody - #DF12141)
ALOX15:一种花生四烯酸代谢酶,能够催化PUFA的氧化,生成具有高反应性的脂质过氧化物。(15 Lipoxygenase 1 Antibody - #DF13494)
SLC7A11:一种谷氨酰胺转运体,能够促进谷氨酰胺的摄取和谷胱甘肽(GSH)的合成,从而抵抗类铁死亡。(xCT Antibody - #DF12509)