Western Blot常见问题分析
2020-07-09 | Affinity
1 简述
Western Blot(简称WB),蛋白质免疫印迹法,是基于蛋白质SDS-PAGE电泳分离和特异性抗体识别蛋白的特性,通过显色技术,以达到检测目的蛋白的技术。该技术广泛应用于定性检测蛋白水平的表达,活性分析与鉴定。该实验步骤多,关键点多,耗时长,每个步骤可能都影响最终的结果,所以实验中经常出现各种问题。本文对WB实验中常出现的各种问题进行归纳总结,并给出相应的解决方法,以便了解WB实验中的注意点和规范操作的必要性,同时对WB出现的问题分析和解决提供参考。
2 实验原理
WB以组织或细胞中的蛋白质为研究对象,经过SDS-PAGE分离蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的一抗起免疫反应,再与酶或同位素标记的二抗起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
3 实验流程图
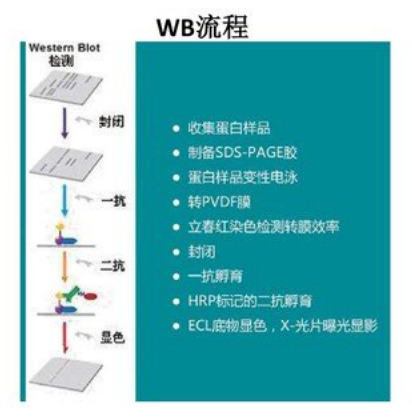
图3-1 WB实验流程图
4 常见问题可能原因和解决办法
WB实验步骤较多,耗时均较长,且每步都影响最终的结果表现。我们将常见问题总结归纳为5大类,见表4-1。下面将对各问题进行分类总结,并对出现该现象的原因进行分析,给出相应的解决办法。
表4-1 常见问题分类
|
章节 |
问题 |
|
4.1 |
无信号,没有阳性条带 |
|
4.2 |
有阳性条带,但条带信号弱 |
|
4.3 |
条带或位置异常(微笑条带;皱眉条带;条带变形;哑铃条带;条带位置异常;条带粘连) |
|
4.4 |
高背景(均一性高背景;非均一性高背景) |
|
4.5 |
非特异性条带多 |
|
4.6 |
其它问题(目标条带是空白,周围有背景;条带中间或周围出现白影;非均一性背景) |
4.1 无信号,没有阳性条带
WB结果中常出现白板或者条带无信号响应现象,如图4-1。我们针对出现该现象可能的原因主要从抗体,抗原,实验操作和缓冲液几方面进行分析。

4.1.1 抗体相关原因
WB中所用到抗体包括一抗和二抗,在该问题上,两个抗体方面可能存在的原因以及相对应的解决方法,归纳总结在表4-2中。
表4-2 抗体相关原因
|
可能原因 |
解决办法 |
|
二抗选用不恰当 |
选择与一抗相匹配的二抗类型,二抗需和一抗宿主的物种相同,如图4-2。 |
|
无足够量抗体结合目标蛋白 |
降低一抗稀释度;使用效价高的一抗;延长抗体孵育时间;膜充分浸润在液体中。 |
|
抗体不适用于western blot |
检查数据库看抗体是否可用于WB |
|
储存时间较长或储存条件不当导致抗体失活 |
选择在有效期内的抗体;工作液现配现用 |
4.1.2 抗原相关原因
抗原即所需要检测目的蛋白,其相关原因可能是未被一抗识别或者是抗原量不足引起,相对应解决办法见表4-3。
表4-3 抗原相关原因
|
可能原因 |
解决办法 |
|
一抗不识别待检测的目的蛋白 |
参照数据库对比抗原序列和蛋白序列,选择合适一抗,确保会发生特异性反应 |
|
抗原量不足或降解 |
每条泳道上样量不低于 20~30 ug, 使用蛋白酶抑制剂并设置阳性对照 |
4.1.3 实验操作相关原因
实验操作规范对于实验结果也至关重要,且需要重复摸索。无条带出现可能是目标蛋白未从胶转移至膜上或者洗膜过度,具体分析见表4-4。
表4-4 实验操作相关原因
|
可能原因 |
解决办法 |
|
转膜不充分 |
使用丽春红S染膜或使用考马斯亮蓝染胶检测转膜效果;检查转膜操作是否正确;优化电转条件;使用两张膜叠加载一起,防止转膜过度,或者使用小孔径膜 |
|
洗膜次数过多 |
减少洗膜次数,洗膜时间和温度 |
4.1.4 缓冲液相关原因
实验中用到多种缓冲液,缓冲液的选择和保存,以及选择合适的显色方式都很重要。无目标蛋白出现可能与缓冲液有关的原因和解决方法见表4-5。
表4-5 缓冲液相关原因
|
可能原因 |
解决办法 |
|
封闭液与一抗或二抗有交叉反应 |
使用温和的去污剂如Tween-20,或更换封闭液 |
|
缓冲液中含有HRP抑制剂 |
避免叠氮化钠和HRP一起使用 |
|
ECL发光液失活 |
更换新的有效的发光液 |
|
显色方式选择 |
延长曝光和显色时间;ECL 显色比DAB显色灵敏度高5-10倍。 |
4.2 有阳性条带,但条带信号弱
WB结果中可能出现有目标蛋白条带,但是目标条带在膜上颜色较浅,如图4-3。该现象原因与4.1中无目标条带较为相似,可能导致该现象的原因我们也从4个方面进行分析,并给出相应的解决方法,具体分析见表4-6。
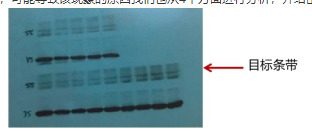
图4-3 条带信号弱案例
表4-6 条带信号弱可能原因和解决方法
|
问题所在 |
可能原因 |
解决办法 |
|
抗体相关 |
抗体浓度过低 |
提高抗体浓度 |
|
|
抗体和抗原亲和力较低 |
提高抗体浓度 |
|
|
抗体活性较低 |
选择在有效期内的抗体;工作液现配现用,避免在长时间内放置 |
|
抗原相关 |
抗原量不足 |
检查待测样本,增加上样量 |
|
实验操作相关 |
转膜不充分 |
使用丽春红S染膜或使用考马斯亮蓝染胶检测转膜效果;检查转膜操作是否正确;优化电转条件;使用两张膜叠加载一起,防止转膜过度,或使用小孔径膜 |
|
|
抗体染色不充分 |
增加抗体浓度;延长孵育时间 |
|
|
洗膜过度 |
缩短洗膜时间 |
|
|
封闭过度 |
减少封闭剂的量或缩短时间,换用不同封闭剂类型 |
|
|
曝光时间过短 |
增加曝光时间 |
|
缓冲液相关 |
可能含有HRP抑制剂 |
避免叠氮钠和HRP一起使用 |
4.3 条带或位置异常
条带或者位置异常是指条带形状异常和条带在膜上与理论位置不一致。条带形状异常常与电泳问题有关,SDS-PAGE电泳的质量至关重要。条带位置异常可能是蛋白出现聚体或被修饰,蛋白出现降解有关。下面就可能出现的各个问题结合实际案例详细讨论。
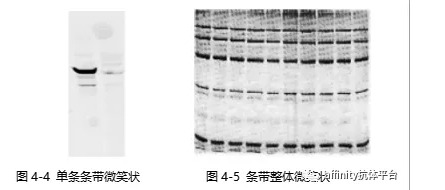
4.3.1 微笑条带
电泳条带或整体出现 “︶ ”形状,如图4-4和4-5,可能原因主要包括两方面。一是电泳速度过快,可通过减少电压等减慢电泳速度。二是电泳温度过高,使得胶变形,可在冷室或者冰浴中进行电泳或者改变电泳pH。
4.3.2 皱眉条带
与微笑状条带相反,条带成现“︵”皱眉状,可能是由于装置不合适,特别可能是凝胶和玻璃挡板底部有气泡,或者两边聚合不完全。可通过调整装置来避免该问题。如图4-6。
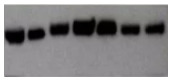
图4-6 皱眉条带
4.3.3 某条条带变形
WB结果中其它条带均正常,某条条带出现变形,如图4-7所示,出现该现象可能的原因是SDS-PAGE胶中有气泡或者不溶性颗粒。我们在配胶过程中要小心,使用无杂质的液体。
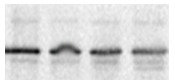
图4-7 条带变形
4.3.4 哑铃状条带
结果中出现条带呈现哑铃状,如图4-8,该现象可能有两个原因导致。一是由于配置胶有问题,胶凝固后不均一,可通过重新配置胶,确保胶质量无问题来避免该现象出现。二是样品可能含有过多杂质,我们在样品使用前对其进行离心,以去除过多杂质。
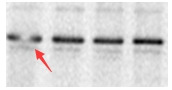
图4-8 哑铃状条带
4.3.5 条带粘连
条带粘连是不同孔目标条带连在一起,中间无间隔,如图4-9所示。出现该现象的原因可能是上样量太多,或者是制胶问题,分离胶和浓缩胶之间有间隙,样品窜孔。可通过减少上样量和提高配胶质量来避免该问题。

图4-9 条带粘连
4.3.6 分子条带大小不对
分子条带大小,即条带位置异常,主要包括三种情况。第一种是出现高于目标蛋白较多的条带,如图4-10,该现象可能是由于蛋白未充分变性,导致蛋白形成二聚体或者多聚体。为避免该现象,可在实验之前加入新配的DTT或b-ME,重新加热使得蛋白充分变性或者直接使用新的蛋白样本。第二种是出现略高于目标蛋白的条带,如图4-11,该现象可能是由于蛋白被修饰,如糖基化/磷酸化等,可导致分子量增加。解决方法是尝试使用酶去除可能的蛋白修饰。第三种是出现比目标蛋白略低的条带,如图4-12,该现象可能是由于蛋白翻译后剪切或者降解。在样品准备时候要在冰上操作或者是加入更过蛋白酶抑制剂,以防止蛋白降解。

4.4 高背景
高背景是WB中常出现的问题,本文将高背景分为两类讨论,包括均一性高背景和斑点或发泡式或闪烁式非均一性高背景。下面针对两种情况均从抗体,实验操作和缓冲液方面进行分析讨论,并给出相应的解决方法,以减少背景,得到漂亮真实可靠的WB结果。
4.4.1 均一性高背景
均一性高背景在实验中常常出现,如图4-13,可能导致该现象的原因较多,均总结于表4-7中,并给出相应的解决方法。
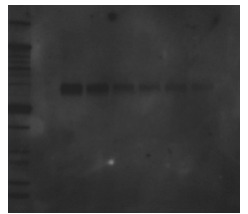
图4-13 均一性高背景
表4-7 均一性高背景原因和解决方法
|
问题所在 |
可能原因 |
解决办法 |
|
抗体相关 |
一抗,二抗浓度较高 |
提高一抗,二抗稀释度,优化稀释条件 |
|
|
一抗,二抗和封闭液结合 |
更换封闭液;更换二抗或降低二抗浓度 |
|
|
储存时间较长或储存条件不当导致抗体失活 |
选择新的抗体 |
|
实验操作相关 |
封闭温度过高,封闭不完全 |
封闭液的选择与优化;使用5%脱脂奶粉封闭;优化封闭时间和温度 |
|
|
膜的问题 |
防止膜过程中干燥;换用NC膜进行实验;使用干净镊子并戴手套操作 |
|
|
孵育中洗膜不充分 |
适当增加洗膜时间和次数;确保在充分震荡的条件下孵育膜,并且抗体充分覆盖膜表面 |
|
|
曝光过度 |
缩短曝光时间,或等5~10分钟后重新使用X光片进行曝光 |
|
缓冲液相关 |
缓冲液中去污剂不够 |
增加TBST中Tween 20的浓度 |
|
|
转膜液,封闭液等不新鲜或被污染 |
现用现配 |
4.4.2 斑点或发泡式或闪烁式非均一性高背景
出现非均一性高背景结果的原因与均一性背景有很多相似之处,也存在差别,如蛋白聚体的影响,非均一性高背景案例图如图4-14所示,可能原因见表4-8。

图4-14 非均一性高背景
表4-8 非均一性高背景原因和解决方法
|
问题所在 |
可能原因 |
解决办法 |
|
抗体相关 |
抗体浓度太高 |
提高一抗,二抗稀释度,优化稀释条件 |
|
|
二抗聚集 |
使用前过滤二抗或者更换二抗 |
|
|
封闭剂中有聚集体 |
使用前过滤封闭剂或者更换 |
|
|
一抗,二抗和封闭液结合 |
更换封闭液;更换二抗或降低二抗浓度 |
|
实验操作相关 |
封闭温度过高,封闭不完全 |
封闭液的选择与优化;增加封闭液中蛋白浓度;优化封闭时间和温度 |
|
|
膜没有正确润湿 |
使用干净镊子并戴手套操作;使用足够液体,膜始终保持湿润;孵育时使用脱色摇床;避免膜重叠,相互覆盖 |
|
缓冲液相关 |
仪器污染 |
保证所有仪器和用具干净;确保膜上无残留胶 |
|
|
转膜液,封闭液等不新鲜或被污染 |
现用现配 |
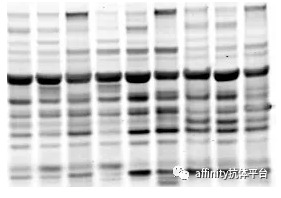
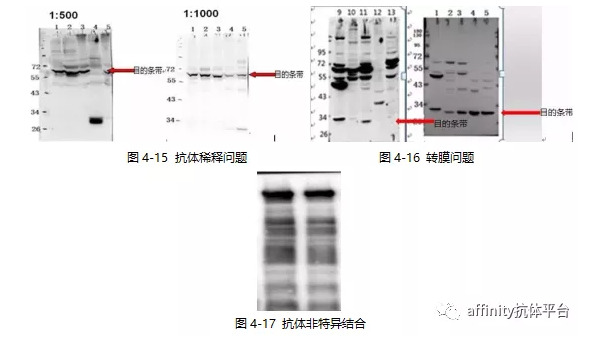
4.5 非特异性条带多
非特异性条带是指除目标蛋白以外的条带,杂带较多影响结果判断,且结果不可靠。下面我们结合实际案例对其可能原因进行分析,并找出相对应的解决方法,见表4-9。
表4-9 非特异性条带多可能原因和解决方法
|
可能原因 |
解决方法 |
|
抗体稀释度问题,如图4-15。 |
降低上样量;提高一抗稀释度。 |
|
抗体未纯化 |
使用单克隆或亲和层析纯化后的抗体,减少非特异条带 |
|
转膜强度太强,导致杂带太强,如图4-16。 |
降低转膜强度(时间和电流),使目标蛋白上方的蛋白少转移到膜上。 |
|
抗体与蛋白非特异性结合,如图4-17。 |
更换抗体 |
|
封闭不完全 |
增加封闭液中蛋白浓度 |
|
细胞传代次数过多,导致其蛋白表达模式分化 |
使用原代或者传代少的细胞株,和现在的细胞株一起做参照 |
|
新蛋白或同族蛋白分享同种表位的不同剪接方式 |
查其文献报导,或BLAST查询,使用说明书报导的细胞株或组织 |
4.6 其它问题
4.6.1 反白现象
反白现象是蛋白条带中间空白,而周围背景正常,如图4-18所示。该现象可能原因是一抗浓度过高,二抗上HRP催化活力太强,同时显色底物处于临界点,反应时间不长,将周围底物催化完,形成了空白。可降低一抗和二抗浓度,或者更换底物来避免该现象。
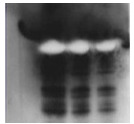
图4-18 反白现象
4.6.2 条带中间或周围出现白圈
条带中间白圈(如图4-19)可能是由于电转中膜和胶之间存在气泡。在转膜过程中要尽量去除气泡,使膜,滤纸和胶紧密结合。同时,抗体孵育的过程中,保持膜的充分浸润。

图4-19 条带中间白圈
5 后记
WB因结果直观易分析为蛋白研究中最常用的方法之一,但也因为其步骤繁杂结果变幻莫测成为很多新手的梦魇。相信看完本文的小伙伴一定会有所感悟,把握好基本原则:先做出条带,再优化结果。好看的结果千篇一律,有趣的条带五花八门,且把它们看作是枯燥科研中的一点小乐趣吧~